Пресс-центр / новости / Наука /
Эффективный анальгетик из яда паука
В яде пауков обнаружено целое семейство пептидов, обладающих совершенно неожиданной активностью: они с высоким сродством и селективностью угнетают пуриновые рецепторы млекопитающих. Пептид, названный пуротоксином-6 (PT6), из яда паука-бокохода Thomisus onustus ингибирует рецепторы P2X3 — важную фармакологическую мишень в ряде болевых синдромов и хроническом кашле. PT6 обладает компактной укладкой и проявляет мощный анальгетический эффект в животных моделях остеоартрита и невралгии тройничного нерва. При этом, в отличие от низкомолекулярных лигандов P2X3, разрабатываемых в качестве лекарственных средств, пуротоксин не вызывает дисгевзии — нарушения чувства вкуса. Исследования пуротоксинов были начаты в ИБХ около 20 лет назад под руководством академика Е.В. Гришина и успешно продолжены А.А. Василевским. Результаты, уникальные в мировом масштабе, опубликованы в авторитетном журнале Molecular Therapy.
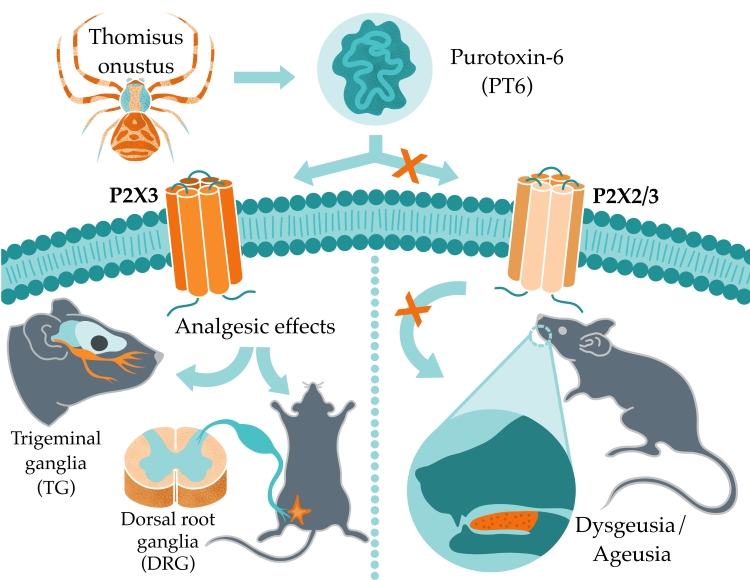
Иллюстрация Анастасии Самоукиной
Ионотропные пуринергические рецепторы (P2X) — ионные каналы, активируемые внеклеточным АТФ. Изоформа P2X3 преимущественно экспрессируется в чувствительных нейронах ганглиев задних корешков спинного мозга и Гассерова узла, играет важную роль в хронической боли и поэтому представляет собой привлекательную мишень для разработки лекарственных препаратов. P2X3 участвует в возникновении болевого синдрома при различных состояниях, включая остеоартрит, синдром раздраженного кишечника, цистит, а также невропатической боли, мигрени и хронического идиопатического кашля. Было разработано несколько низкомолекулярных антагонистов P2X3; некоторые проходят клинические испытания, и один был недавно одобрен в Японии, Швейцарии и Европейском союзе для лечения рефрактерного хронического кашля. Важным недостатком большинства известных ингибиторов P2X3 является их побочное действие. В частности, низкая селективность в отношении P2X3 по сравнению с гетеромером P2X2/3 вызывает дисгевзию, т.е. искажение вкусовых ощущений — это главная проблема, с которой сталкиваются во время клинических испытаний.
Проведенная работа включала несколько этапов. Еще в начале 2000-х гг. в ИБХ был выделен и охарактеризован пуротоксин-1 (PT1) — первый селективный высокоаффинный пептидный лиганд P2X3. Затем были получены библиотеки кДНК ядовитых желез разнообразных пауков. Оказалось, что гомологи PT1 формируют большое семейство пуротоксинов (рисунок 1A). Авторы выбрали наименьший гомолог, названный PT6, который мог быть получен в бактериальной системе экспрессии с высоким выходом. Здесь ключевую роль сыграло представление о природных ядах как комбинаторных библиотеках: токсины формируют библиотеки родственных соединений, похожие на те, что используются фармкомпаниями. Природная библиотека пуротоксинов подсказала «минималистичную» структуру PT6. С помощью ЯМР-спектроскопии была изучена пространственная структура PT6 в растворе; в ней сокращена петля β-шпильки и удалена одна дисульфидная связь по сравнению с PT1 (см. рисунок 1B, C).
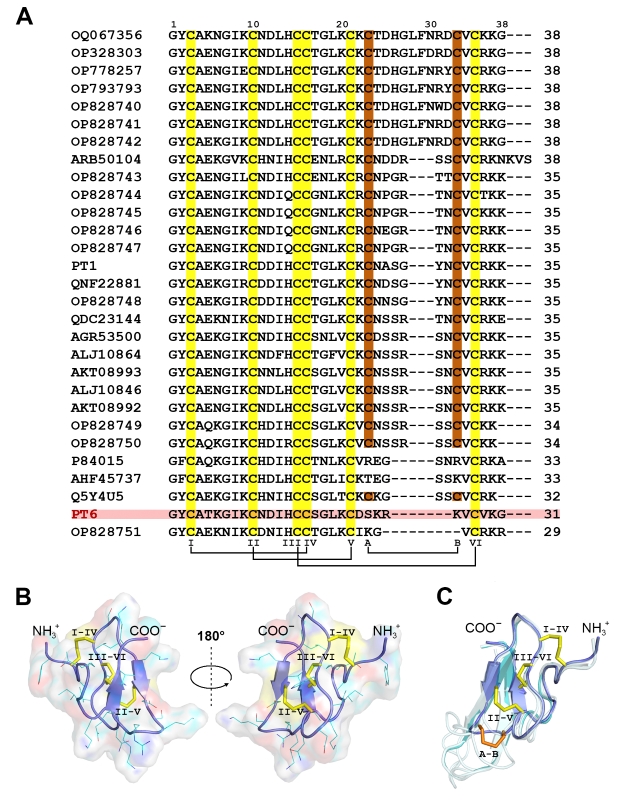
Рисунок 1. Структура пуротоксинов. (A) Комбинаторная библиотека пуротоксинов. Аминокислотная последовательность PT6 выделена. Расположение дисульфидных мостиков показано снизу. Остатки цистеина, формирующие дисульфидную связь, которая отсутствует у PT6, выделены коричневым. (B) Пространственная структура PT6 (PDB ID: 6F61). (C) Сравнение структур PT6 и PT1 (PDB ID: 2KGU), а также моделей других пуротоксинов, построенных по гомологии. Полипептидная цепь PT6 окрашена фиолетовым, PT1 — голубым. Показаны дисульфидные мостики, окрашенные как на панели A.
Ученые подтвердили, что PT6 сохранил специфическую активность в отношении P2X3. Для этого были использованы как рекомбинантные рецепторы, экспрессированные в клеточных линиях, так и выделенные нейроны спинальных ганглиев и Гассерова узла. Важно, что PT6 с высокой аффинностью (EC50 = 8 нМ) ингибирует P2X3, при этом вообще не активен на P2X2 или гетеромерах P2X2/3 даже в микромолярных концентрациях (рисунок 2).
PT6 проявлял антиноцицептивную активность в неспецифических, но широко используемых тестах на животных, таких как формалиновый тест, CFA тест, «уксусные корчи». Дополнительно была подтверждена селективность PT6 с использованием мышей с нокаутом гена P2rx3, которые не имеют функционального рецептора P2X3: PT6 утратил обезболивающую активность в нокаутных мышах. Затем авторы исследовали активность PT6 в ряде животных моделей болевых синдромов с известным или предполагаемым участием P2X3, включая модели остеоартрита и невралгии тройничного нерва. Во всех случаях PT6 показал высокую эффективность. Более того, эффективные дозы пуротоксина (0,01–0,1 мг/кг) были на несколько порядков меньше доз традиционно используемых анальгетиков, включая нестероидные противовоспалительные и опиоидные препараты. Наконец, было проанализировано, влияет ли PT6 на восприятие вкуса — в сравнении с низкомолекулярными ингибиторами P2X3, которые в настоящее время разрабатываются фармкомпаниями. Оказалось, что в отличие от малых молекул, PT6 не вызывает дисгевзии.
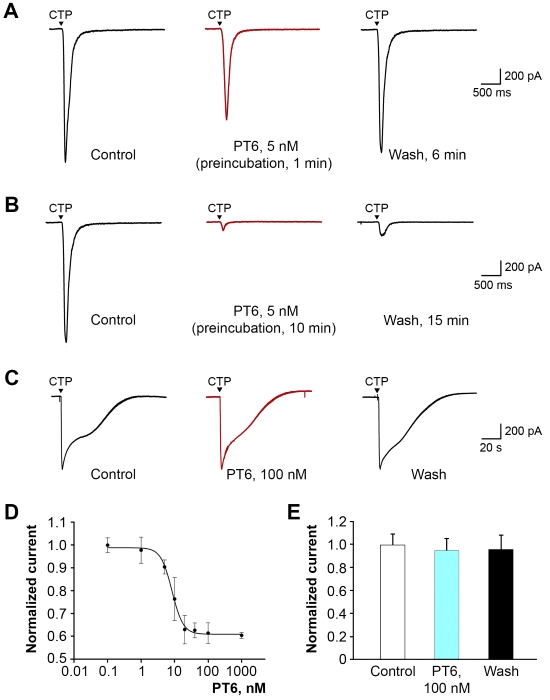
Рисунок 2. Специфическая активность PT6 на рецепторах P2X3. (A и B) Записи токов в клетках CHO, экспрессирующих P2X3, в ответ на приложение активатора (100 мкМ ЦТФ). При кратковременной (1 мин) предварительной инкубации (A) эффект 5 нМ PT6 был небольшим и полностью обратимым. При длительной предварительной инкубации (B) ток был значительно подавлен, вплоть до полного ингибирования, которое было обратимым лишь частично. (C) Записи токов в клетках, экспрессирующих гетеромеры P2X2/3. (D) Кривая доза–ответ для кратковременной инкубации описывается уравнением Хилла; EC50 = 8,4 ± 0,5 нМ, h = 2,7 ± 0,3. (E) Ответы, зарегистрированные для гетеромеров P2X2/3.
Большинство работ было выполнено в ГНЦ ИБХ РАН — разными подразделениями. В исследованиях принимали важное участие коллеги из других организаций и научных центров России:
- компания «Анальгетики будущего», резидент «Сколково», занимается разработкой инновационного анальгетика на основе пуротоксина
- в Институте биофизики клетки РАН выполнено исследование механизма действия пуротоксинов
- в Институте фундаментальной медицины и биологии Казанского федерального университета изучена активность пуротоксинов на тройничном нерве
- в Центре высокоточного редактирования и генетических технологий для биомедицины Института биологии гена РАН получены нокаутные мыши
- в ФГБНУ «НИИ фармакологии имени В.В. Закусова» проведены тесты анальгетической активности на нокаутных мышах
- в Институте медико-биологических проблем РАН изучена активность пуротоксинов в модели невралгии
6 марта


