Пресс-центр / новости / Наука /
Блокада макрофагов для улучшения доставки наночастиц или бесконечные циклы в наномедицине
Цикл «обнаружить-восхититься-исследовать-разочароваться и забыть» может быть довольно обычной рутиной в исследованиях. Тем не менее в некоторых областях он, кажется, может повторяться много раз. Свежая статья ученых из ИБХ РАН и Университета Бостона анализирует один из таких циклов в области блокады иммунной системы организма наночастицами. Исследование показывает, что прогресс в создании новых наноматериалов наконец может позволить разорвать замкнутый круг и ввести этот метод в клиническую практику для улучшения терапии рака. Работа опубликована в престижном журнале Nature Communications.
Одним из барьеров использования наночастиц в медицине является активность макрофагов, клеток иммунной системы, которые обнаруживают и нейтрализуют частицы задолго до того, как они достигают своей цели. Процесс настолько эффективный, что в среднем менее 1% от вводимых частиц с лекарством связывается с опухолью. Это не только снижает терапевтический эффект, но и повышает токсичность для нормальных органов, таких как печень и селезенка. Для борьбы с этим можно заранее ввести в организм нетоксичные частицы, единственной целью которых будет отвлечение и насыщение макрофагов. Если затем ввести в организм частицы с лекарством – они будут дольше находиться в крови и лучше накапливаться в опухоли (Рисунок 1). Данный метод получил название блокады макрофагов и, по стечению обстоятельств, переизобретался несколько раз за последние 100 лет.
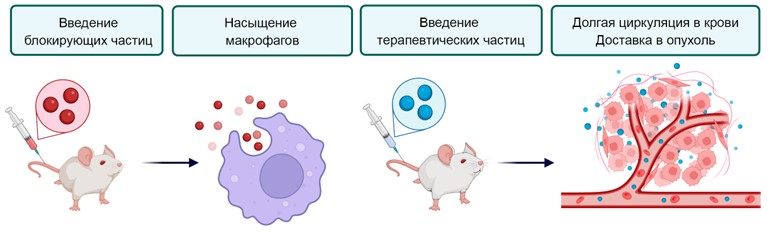
Рисунок 1. Метод блокады макрофагов. Введение в организм блокирующих нетоксичных наночастиц насыщает макрофаги и отвлекает иммунные клетки. После этого, вводимые частицы с лекарством дольше находятся в крови и могут достигнуть опухоли.
Первое обнаружение феномена блокады было совершено в 1910-х годах вскоре после открытия макрофагов И.И. Мечниковым. Ученые обнаружили, что наночастицы углерода в чернилах по-разному выводятся из крови животных, в зависимости от того, что в них вводилось раньше. Эта ранняя эра позволила установить схожесть механизмов блокады у разных животных от лягушек и рыб до птиц и млекопитающих. В клинические исследования блокада не пошла, потому что повторяемость состава частиц в чернилах оставляла желать лучшего. Кроме того, долгое время для блокады использовались токсичные наноматериалы, такие как частицы радиоактивного тория – которые безвозвратно убивали клетки в организме.
Второй цикл интереса к блокаде макрофагов наблюдался в 1960-1980х годах. В данный период появилось понимание основных молекулярных механизмов блокады, а токсичность подхода сильно снизилось. В качестве основных блокаторов стали использоваться наночастицы из желатина и белков, которые должны были быстро деградировать в организме. На данном цикле метод дошел до тестирования на людях и ранние результаты показали его эффективность в продлении циркуляции частиц с лекарством. Тем не менее в 1980-х наномедицина пережила свою первую революцию – был изобретен альтернативный метод продления циркуляции за счет покрытия частиц маскирующим полимером, полиэтиленгликолем. Использование полимера показалось более перспективным для клиники и о блокаде макрофагов забыли еще на 30 лет.
Покрытие полиэтиленгликолем действительно позволило ввести ряд лекарств в клиническую практику. Тем не менее, метод имел недостатки: он был не универсален, многие наноматериалы не удавалось успешно модифицировать, а на компоненты полимера возникала иммунная реакция у части пациентов. Третий цикл переизобретения блокады не заставил себя ждать. В 2014 году группа ученых из Китая предложила вводить нетоксичные липосомы для блокады и показали МРТ визуализацию и последующую терапию опухолей у мышей. Появились новые методы блокады макрофагов от пространственной изоляции клеток за счет покрытия полимерами, до генетической модификации части иммунных клеток (Рисунок 2). В 2020 году коллектив российских ученых из ИБХ РАН предложили использовать состаренные эритроциты для блокады макрофагов. В цикле работ целый ряд нетоксичных и разлагаемых частиц был опробован для блокады, что является одним из направлений работы лаборатории молекулярной иммунологии ИБХ РАН. Но учли ли мы ошибки прошлого или о методе снова забудут лет через 10?
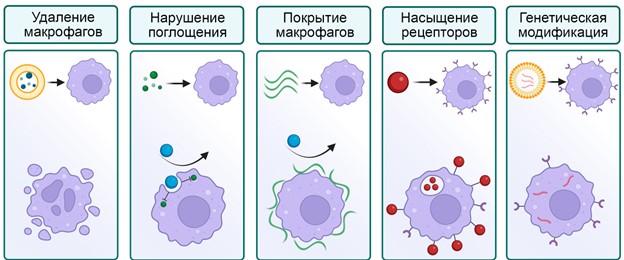
Рисунок 2. Некоторые стратегии для «блокады макрофагов». Слева на право: удаление макрофагов токсичными наноматериалами; нарушение процесса поглощения частиц молекулярными веществами; покрытие поверхности макрофагов полимерами; насыщение макрофагов после поглощения наночастиц; генетическая модификация макрофагов.
В перспективе, опубликованной в Nature Communications, авторы впервые провели обширный мета-анализ эффективности блокады макрофагов для продления времени циркуляции частиц и повышения их доставки в опухоль. Оказалось, что при явном тренде на использование нетоксичных блокаторов одновременно наблюдается рост эффективности метода – на 40% в «последнем цикле». По времени циркуляции частиц в кровотоке эффективность в среднем достигла того уровня, при котором возможна терапия опухолей. Кроме того, авторы проанализировали те свойства, которые влияют на блокаду и последующую терапию. Например, оказалось, что крупные частицы лучше блокируют макрофаги, вероятно из-за более быстрого связывания с клетками. Кроме того, блокирующие частицы похожие на терапевтические вызывают наиболее сильную блокаду. Это связано с истощением специфических опсонинов в крови – белков, через которых происходит распознавание макрофагами. Интересно, что метод в 10 раз лучше повышает доставку таргетных терапевтических частиц, которые нацелены на опухолевые клетки, чем простых наночастиц. Блокада современными наноматериалами наблюдается в течение нескольких часов, после чего иммунная система полностью восстанавливается. Это открывает возможности для использования метода в клинической практике.
В заключении авторы обсуждают барьеры и перспективы дальнейшего развития области. Наиболее перспективными авторы считают использование заменителей крови и липидных частиц из «внутривенного питания» для блокады в клинических исследованиях. Кроме того, блокада макрофагов может быть потенциально использована в других областях – для улучшения иммунизации, доставки вирусов и генетического материала.
Работа выполнена при поддержке гранта РНФ № 21-74-30016.
14 июня 2024 года


