Пресс-центр / новости / Наука /
Гликановый состав микровезикул из эндотелиальных клеток
В отличие от экзосом, данные о гликоме микровезикул (МВ) практически отсутствуют. Сотрудники Лаборатории углеводов и Лаборатории молекулярной биофизики ИБХ РАН изучили гликановый состав МВ, полученных из эндотелиальных клеток, с использованием 21 растительного лектина. Полученные результаты показали, что в МВ доминируют олиголактозамины, частично α2-6-сиалилированные в виде N-гликанов. Наиболее ярким отличием МВ от материнских клеток является практически полное отсутствие α2-3-сиалилированных гликанов; показано, что это не результат действия внеклеточных гликозидаз. Кроме того, по сравнению с материнскими клетками, в МВ понижен уровень некоторых Man-содержащих гликанов. Полученные результаты свидетельствуют об избирательности переноса интегральных белков плазматической мембраны в МВ.
Большая часть исследований гликанового профиля внеклеточных везикул посвящена экзосомам. О гликоме микровезикул (МВ) данных значительно меньше, в особенности полученных из эндотелиальных клеток человека. В данной работе авторы сфокусировались на исследовании гликанового состава МВ эндотелиальных клеток EA.hy 926, чтобы в дальнейшем, опираясь на эту информацию, предсказать, какие лектины на адресных клетках потенциально способны участвовать в их захвате. Микровезикулы выделяли из супернатанта клеток ультрацентрифугированием после удаления дебриса и апоптотических телец, размер частиц находится в диапазоне 180-250 нм (рис. 1А), диаметр большинства частиц составляет 180 нм (рис. 1Б).

Рис. 1. Характеристика микровезикул из клеток EA.hy 926. А: анализ распределения микровезикул по размерам с помощью метода динамического светорассеивания; (Б): морфология микровезикул, полученная с помощью просвечивающей электронной микроскопии, масштаб=1000 нм.
Гликановый состав микровезикул (МВ) исследовали в разработанной нами твердофазной системе, а также цитофлуориметрически, с помощью набора растительных лектинов. В твердофазной системе (рис. 2) из 21 лектина, сигнал на уровне фоновых значений наблюдался для тех, которые узнают терминальные остатки Fucα (LTL и UEA I), GalNAcα (SBA, GSL I, VVA), GlcNAcβ (GSL2), α2-3-сиалилированные (MAA) и О-гликаны (PNA); то есть эти лектины не связывались с MВ. Из лектинов, узнающих Manα-содержащие гликаны, с MВ связывались LCA и PSA, но не PHA-L. В топ-8 попали лектины, узнающие олиголактозаминовые цепи (RCA, ECA, DSA и STL, рис. 2), замещенные лактозамины (LEL), N-гликаны комплексного (PHA-Е) и Man-богатого (LCA, PSA) типов.
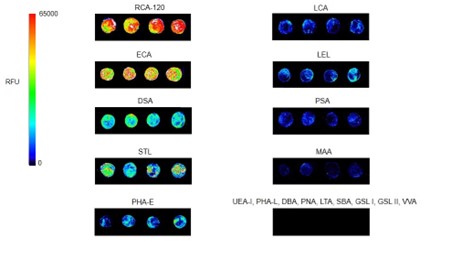
Рис. 2. Связывание микровезикул, иммобилизованных на поли-L-лизин, в твердофазной системе. Представлено связывание лектинов с МВ (в радужной цветовой шкале), где RFU – относительная единица флуоресценции.
Для анализа цитофлуориметрией были взяты лектины, взаимодействие с которыми дополняли данные твердофазного анализа, а именно СonA, SNA и Jacalin. В целом, данные твердофазного анализа и цитофлуориметрии совпали (рис. 3, верхняя панель): с МВ связывались лектины, узнающие Manα-содержащие (ConA), α2-6-сиалилированные (SNA) и О-гликаны (Jacalin). При анализе цитофлуориметрией, как и в твердофазной системе, лектины МАА и UEA I не связывались с микровезикулами (рис. 3, верхняя панель). Из лектинов, узнающих Fucα-содержащие гликаны, с МВ связывался AAL, который, в отличие от UEA I, узнает любые фукозилированные гликаны (рис. 3, верхняя панель), не только α1-2. Полученные результаты позволили сделать вывод, что гликановые профили материнских клеток и MВ лишь частично совпадают, в них выявляются олиголактозамины и α2-6-сиалилированные гликаны. В то же время наблюдается ряд существенных отличий, наиболее ярким из которых является резкое уменьшение α2-3-сиалилированных гликанов в МВ. Кроме того, в микровезикулах по сравнению с материнскими клетками, обнаруживаются N-гликаны, преимущественно комплексного типа, тогда как на клетках представлены гликаны как комплексного, так и маннозобогатого типов.
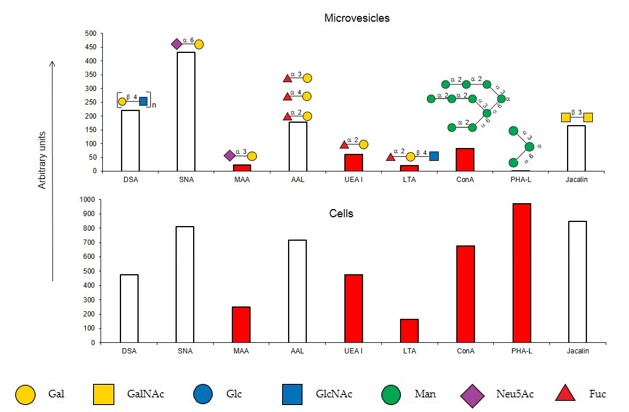
Рис. 3. Сравнение гликановых профилей микровезикул и клеток, цитофлуориметрия, по оси ординат – значение флуоресценции.
Измерение активности гликозидаз и анализ связывания лектинов с МВ, выделенными из клеток с разрушенным гликокаликсом (или из клеток, в которых нарушен биосинтез гликанов в составе гликопротеинов или гликолипидов) показали, что: 1) в микровезикулах присутствуют гликопротеины, в которых представлены как N-, так и О-гликаны; 2) уменьшение α2-3-сиалилированных и Fucα1-2-терминированных гликанов не является результатом их маскировки протеогликанами и гликопротеинами гликокаликса, или действия фукозидазы и нейраминидазы. Полученные результаты позволяют предположить, что интегральные белки плазматической мембраны переходят в МВ избирательно.
Работа выполнена при поддержке гранта РНФ №22-24-00672 и опубликована в журнале International Journal of Molecular sciences.
2 июля 2024 года


