Press-room / news / Science news /
New Type of Interaction of Snake Three-Finger α-Neurotoxins with Nicotinic Acetylcholine Receptors
Nicotinic acetylcholine receptor of α7 type (α7-nAChR) presented in the nervous and immune systems and epithelium is a promising therapeutic target for cognitive disfunctions and cancer treatment. Weak toxin from venom of cobra Naja kaouthia (WTX) is a non-conventional three-finger α-neurotoxin from Naja kaouthia venom, targeting α7-nAChR with weak affinity. There were no data on interaction mode of non-conventional neurotoxins with α7-nAChR.
In a new work, the researches of the Laboratory of Bioengineering of Neuroreceptors and Neuromodulators, the Laboratory of Structural Biology of Ion Channels, the Group for Analysis of the Structure of Membrane Proteins in Silico, and Laboratory of Biomolecular Modeling of the Institute of Bioorganic Chemistry, Russian Academy of Sciences, together with the researches of the National Research Center «Kurchatov Institute», Institute of Biomedical Chemistry, and Lomonosov Moscow State University using α-bungarotoxin (classical three-finger α-neurotoxin with high affinity to α7-nAChR), we showed applicability of cryo-EM to study interactions of α7-nAChR extracellular ligand-binding domain (α7-ECD) with its ligands, despite the proximity of the size of the complex to the lower limit of the sizes of biomolecules available for study by this method of structural biology.
Cryo-EM structure of the α7-ECD/WTX complex together with NMR data on membrane active site in the WTX molecule and mutagenesis data allowed to reconstruct the α7-nAChR/WTX structure in the membrane environment. WTX interacts at the entrance to the orthosteric site located at the receptor intersubunit interface and simultaneously forms the numerous contacts with the membrane surface. WTX interaction mode with α7-nAChR significantly differs from that of long-chain and short-chain α-neurotoxins, which do not contact the membrane. Our study reveals the important role of the membrane for interaction of non-conventional α-neurotoxins with the nicotinic receptors.
The study is published in the Communications Biology
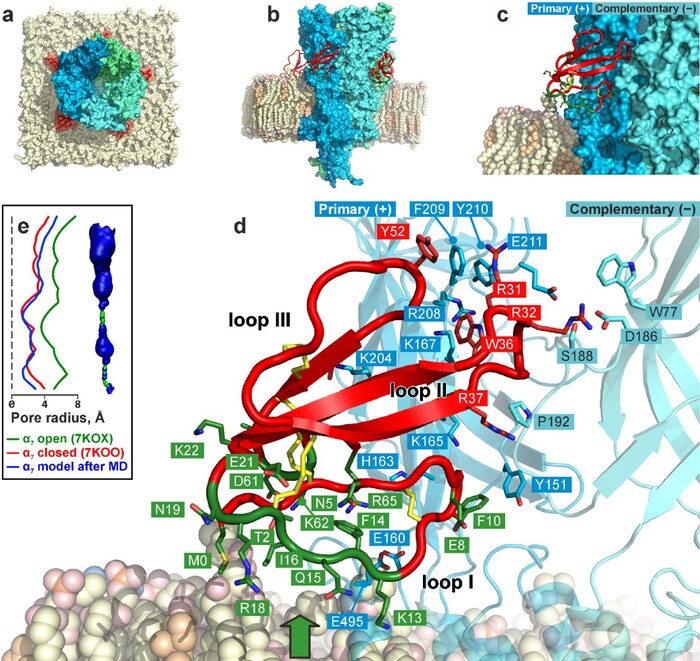
Figure 1. Structure of α7-nAChR/WTX complex in membrane environment.
december 14, 2022


