Лаборатория полимеров для биологии
В Лаборатории создаются композиционные сорбенты для биосепарации, модельные мембраны на основе монослоев и липосом, дисперсные иммунодиагностикумы, системы для микрокапсулирования ферментов и клеток и системы для гибридизационного анализа. Отдельное направление исследований включает работу в рамках реализации проектов Сколково, проводимых совместно с компаниями-резидентами Фонда Сколково ООО «Биостэн» и АО «Медтехнопроект».
Группа под руководством Дмитрия Валерьевича Капустина занимается разработкой методов прямого синтеза нанокомпозитов с усовершенствованной морфологией, обеспечивающих локализацию процесса полимеризации в поверхностных слоях носителей и введение дополнительных функциональных групп (в том числе, биолигандов) в получаемые материалы. На основе таких нанокомпозитов (в зависимости от природы полимерного модификатора) может быть получен ряд эффективных материалов для биоаналитических целей.
Запатентованы многоцелевые сорбенты (на основе дисперсных носителей, а также капилляров, мембран, монолитов, кремниевых чипов и т. д.), для одностадийного выделения и очистки биополимеров (нуклеиновых кислот, белков и пептидов) (рис. 1). Сорбенты используются при разработке наборов и протоколов для эффективной диагностики патогенов человека, в частности, методом ПЦР, а также в качестве носителей для проведения масс-спектрометрии (патент Patent WO 2011004308 (A1)). В частности, Группа работает над созданием:
- гетерогенных биокатализаторов на основе композиционных матриц, модифицированных smart-полимерами с иммобилизованными биолигандами (ферментами), эффективных в водных и органических средах.
- методов прямого синтеза нанокомпозитов с усовершенствованной морфологией (рис. 1), обеспечивающих локализацию процесса полимеризации в поверхностных слоях носителей и введение дополнительных функциональных групп (в том числе, биолигандов) в получаемые материалы.
- изучением механизмов сорбции биополимеров на поверхности разработанных материалов. В частности, показано, что хроматографическое поведение разработанных композитов определяется не морфологией поверхностного слоя, а химическим строением полимерного модификатора.
- доказано, что разработанные композиты полезны не только при селективном разделении смесей биомакромолекул (нуклеиновых кислот и белков), но также эффективно взаимодействуют со сложными надмолекулярными структурами, такими как вирусные частицы (в частности, с РНК-содержащими оболочечными вирусами, с вирусом гриппа B/Colorado/06/2017 подобным вирусу B/Victoria/2/87. Снижение титра вируса в вируссодержащих пробах после пропускания через биосепарирующие элементы с разработанными композитами составило, в среднем, 2 – 3.5 lg ТЦД50/мл, в большинстве экспериментов вирусные частицы удерживались полностью.
Группа сотрудничает с научно-исследовательскими подразделениями Института, а также с ФНИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава РФ, с НПП «Технофильтр» (г. Владимир) и с рядом других институтов и компаний.
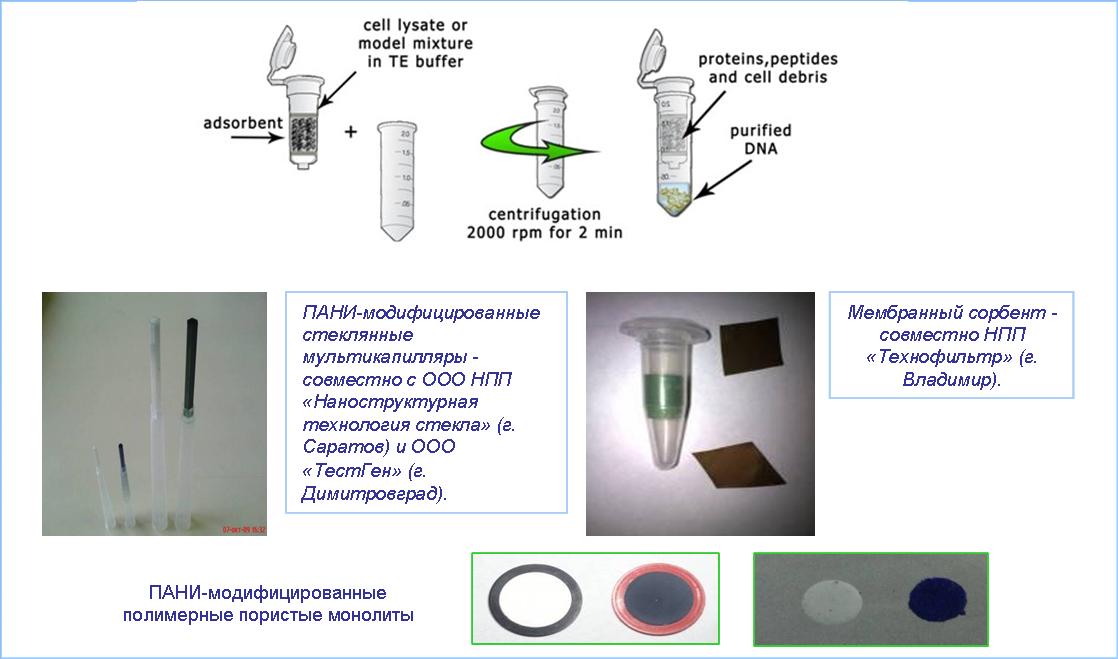
Рис. 1. Схема одностадийного выделение ДНК из лизатов и примеры разработанных «биосепарационных элементов».
Исследования группы Аллы Николаевной Генераловой направлены на разработку методов получения полимерных микросфер для решения различных биоаналитических задач. В частности, за последнее время А.Н. Генераловой с коллегами были разработаны:
- методы синтеза окрашенных и флуоресцентных полиакролеиновых и сополимерных микросфер для получения новых биоаналитических реагентов для высокочувствительного экспресс-анализа белков, гаптенов и нуклеиновых кислот.
- композитные сополимерные микросферы, содержащие флуоресцентные CdSe/ZnS нанокристаллы в непосредственной близости к поверхности, что позволяет регистрировать изменения флуоресценции при незначительном изменении условий окружения, таких как рН, ионная сила, температура и т.д. и использовать их в качестве оптических сенсоров (рис. 2).
- методы получения биосовместимых полимерно-капсулированных реагентов на основе наночастиц с антистоксовой фотолюминесценцией для тераностики (работа проводится совместно с Лабораторией молекулярной иммунологии ИБХ РАН, ФНИЦ «Кристаллография и фотоника» РАН) (рис. 3).
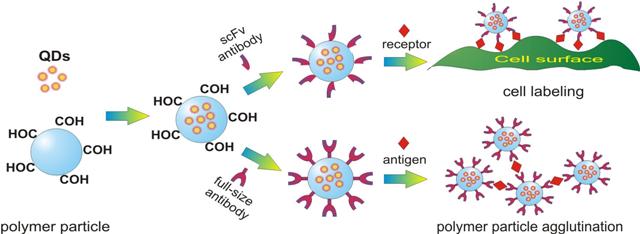
Рис. 2. Включение флуоресцентных CdSe/ZnS нанокристаллов в полимерные микросферы и их применение в биоанализе.
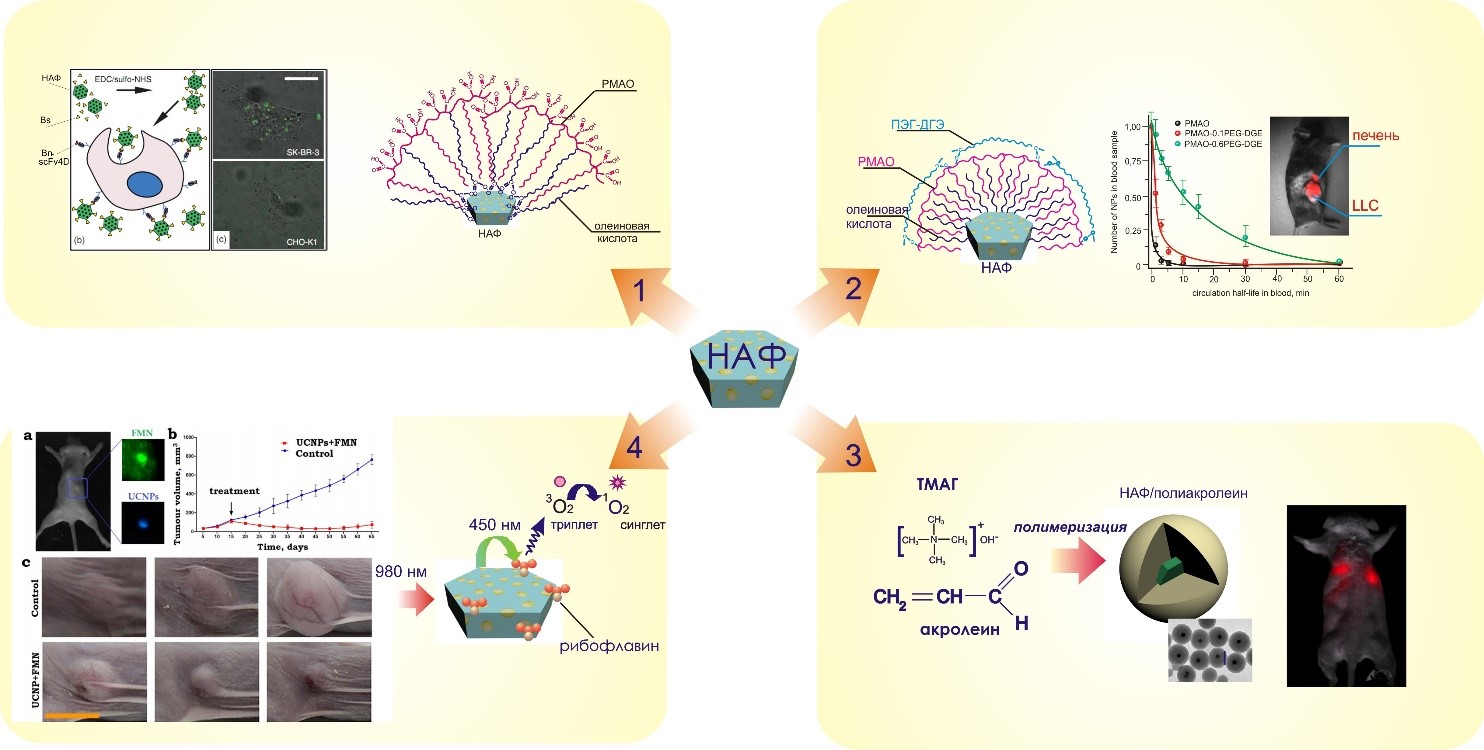
Рис. 3. Методы модификации НАФ и анализа на их основе.
Лаборатория «Полимеры для биологии» была создана в 1979 году. Решение о ее создании было принято после нескольких встреч В. П. Зубова (в то время зав. лабораторией кафедры высокомолекулярных соединений химического факультета МГУ) и академика Ю. А. Овчинникова (в то время директора Института химии природных соединений АН СССР, вице-президента Академии наук) на симпозиумах и конференциях. На этих встречах речь шла о роли материаловедения в развитии современной физико-химической биологии, о полной зависимости этой области науки от поставок необходимых реактивов и материалов из-за рубежа, а также об отсутствии в стране специализированных исследовательских подразделений по разработке и выпуску новых материалов для биологии и биотехнологии.
Потребность в высокочистых концентрированных препаратах биологически активных соединений, в первую очередь, биополимеров (нуклеиновых кислот и белков), привела к созданию ряда эффективных сорбционных композиционных материалов (сорбентов), объединяющих полезные механические качества жесткого нерастворимого носителя с уникальными сорбционными свойствами полимерных модификаторов (в первую очередь, фторполимеров и полианилинов). В качестве примеров практического использования таких материалов можно привести одностадийные протоколы выделения ДНК из лизатов бактериальных культур, растительных тканей, крови и т.д. Полученные очищенные препараты ДНК пригодны для непосредственного использования в ПЦР-анализе. Указанные материалы с успехом применяли в процедурах экспресс-пробоподготовки при проведении ПЦР-диагностики HBV-вируса (гепатита B человека), Mycobacterium tuberculosis complex, ряда бактериальных и грибковых урогенитальных инфекций и др.
Совместно с ФНИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава РФ доказано, что разработанные композиты полезны не только при селективном разделении смесей биомакромолекул (нуклеиновых кислот и белков), но также эффективно взаимодействуют со сложными надмолекулярными структурами, такими как вирусные частицы (в частности, с РНК-содержащими оболочечными вирусами, с вирусом гриппа B/Colorado/06/2017 подобным вирусу B/Victoria/2/87. Снижение титра вируса в вируссодержащих пробах после пропускания через биосепарирующие элементы с разработанными композитами составило, в среднем, 2 – 3.5 lg ТЦД50/мл, в большинстве экспериментов вирусные частицы удерживались полностью.
Использование частично фторированных полимеров для модифицирования носителей также дает возможность иммобилизации различных биолигандов. В лаборатории разработан способ получения стабильного фторполимерсодержащего носителя для твердофазного синтеза олигонуклеотидов на основе пористого кремнезема, предварительно модифицированного фторсополимером, содержащим активные эфирные группы. После соответствующей химической модификации нуклеозидом полученный материал был успешно применен в качестве носителя при твердофазном синтезе олигонуклеотидов.
Разработана и запатентована (совместно с компанией Royal Philips Electronics) новая эффективная биоаналитическая система на основе кремниевого носителя для проведения масс-спектрометрии в формате SELDI, в которой использовано свойство полианилинсодержащих покрытий разделять белки (пептиды) в зависимости от значения pI индивидуальных компонентов, а также накапливать энергию излучения лазера.
Разработанные синтетические подходы были с успехом применены для создания эффективных биокатализаторов на основе кремнезема, модифицированного термочувствительным сополимером N-винилкапролактама с 2-гидкроксиэтилметакрилатом. На полученный материал иммобилизовали липазу из Pseudomonas fluorescence. Полученный биокатализатор отличается повышенной ферментативной активностью по сравнению с препаратами нативной липазы. При этом ферментативная активность сохранялась как в водных, так и в органических средах.
Преимущества использования композиционных материалов с наноструктурными элементами были также реализованы при создании биоаналитических систем на основе полимерных частиц, содержащих различные метки (флуоресцентные, хромофорные). Разработанные в лаборатории «Полимеры для биологии» способы получения дисперсий полимерных частиц на основе полиакролеина позволили создать целый ряд окрашенных биоаналитических реагентов для постановки реакции латекс-агглютинации с целью определения различных аналитов, таких как дифтерийный токсин, ферритин, гербициды (2,4-D, атразин, симазин), антитела к липополисахаридам клеточной стенки условно-патогенных бактерий, тиреоглобулин, пероксидаза щитовидной железы, антитела кмикобактерии туберкулеза и др. Работа проводилась совместно с широким кругом научных организаций (НИИ вакцин и сывороток им. И.И. Мечникова РАМН, НПЦ «Медицинская иммунология», НИИ глазных болезней им. Гельмгольца и др.).
В качестве перспективных флуорофоров большое внимание привлекают полупроводниковые нанокристаллы CdSe/ZnS, также известные как квантовые точки (QDs). Набор коллоидно-стабильных полимерных флуоресцентных частиц различного диаметра (0.15 - 0.52 мкм) получен путем введения QDsв предварительно синтезированные частицы на основе сополимеров акролеина и стирола. Полученные частицы конъюгировали с моноклональными антителами к антигену Yersinia pestis и использовали в реакции пассивной агглютинации как в режиме экспресс-анализа, проводимого на стекле, так и в виде наиболее простого и чувствительного полуколичественного метода иммуноанализа – в планшете. На примере конъюгатов флуоресцентных полимерных частиц с антителами 4D5scFvпродемонстрирована возможность специфического маркирования рецептора HER2/neuна поверхности мембраны клеток аденокарциномы яичника человека SKOV-3 in vitro. Работа проводилась совместно с лабораториями молекулярной биофизики и молекулярной иммунологии ИБХ РАН.
В последнее время большой интерес привлекают наночастицы с антистоксовой фотолюминесценцией (НАФ). Они представляют собой неорганическую матрицу NaYF4, легированную ионами редкоземельных металлов Yb3+, Er3+ или Tm3+. НАФ возбуждаются спектрально выгодным источником света (975 нм) в «окне прозрачности» биологической ткани, который обеспечивает глубокое проникновение света с минимальным поглощением и рассеянием, НАФ обладают гидрофобными свойствами и для создания тераностических реагентов на основе НАФ их необходимо модифицировать. В лаборатории «Полимеры для биологии» разработаны способы модификации с использованием амфифильных полимеров, что позволило создать на их основе таргетные нанокомплексы для мечения онкомаркера HER2/neu (путь 1). Разработка оригинального дизайна нанокомплексов НАФ, где получена «корона» из химически связанных с поверхностью молекул ПЭГ, привела к увеличению времени циркуляции в крови животных и реализации прижизненной доставки НАФ в опухоль (путь 2). Капсулирование НАФ в частицы полиакролеиновых дисперсий в процессе их синтеза явилось основой для создания реагентов при исследовании биораспределения частиц по органам при внутривенном введении (путь 3). Уникальные оптические свойства НАФ легли в основу создания нанокомплексов с рибофлавином, способных генерировать активные формы кислорода под действием ИК излучения за счет реализации FRET эффекта, что позволило использовать эти нанокомплексы для фотодинамической терапии опухолей (путь 4). Работа проводилась совместно с Лабораторией молекулярной иммунологии ИБХ РАН, ФНИЦ «Кристаллография и фотоника» РАН, Московским технологическим университетом, РОНЦ им. Н.Н. Блохина и Университетом Маккуори (Австралия)).
| ФИО | Должность | Контакты |
|---|---|---|
| Генералова Алла Николаевна, д.х.н. | г.н.с. | |
| Зубов В.П., проф., д.х.н. | г.н.с. | |
| Капустин Дмитрий Валерьевич, д.х.н. | с.н.с. | |
| Хайдуков Е.В. | с.н.с. | |
| Ягудаева Елена Юрьевна, к.х.н. | с.н.с. | |
| Вихров Александр Анатольевич, к.х.н. | н.с. | |
| Жигис Л.С., к.х.н. | н.с. | |
| Простякова Анна Игоревна, к.х.н. | с.н.с. | |
| Демина Полина Андреевна, к.х.н. | м.н.с. | |
| Сочилина Анастасия Владимировна, к.х.н. | м.н.с. | |
| Разгуляева О.А. | инженер | |
Ранее здесь работали | ||
| Марквичева Елена Арнольдовна, д.х.н. | ||
| Акасов Роман Александрович, к.х.н. | ||
| Зуева В.С., к.б.н. | ||
| Селина Оксана Евгеньевна, к.х.н. | ||
| Сизова Светлана Викторовна, к.х.н. | ||
| Зайцева-Зотова Д.С., к.х.н. | ||
| Мясоедов М.С. | ||
| Гилёва Анастасия Михайловна | ||
| Дроздова Мария Георгиевна | ||
| Хованкина Анна Викторовна | ||
| Морозова С.А. | ||
 Загрузка...
Загрузка...Научные проекты
 Загрузка...
Загрузка...Генералова Алла Николаевна
Москва, ул. Миклухо-Маклая, 16/10 — На карте
 Загрузка...
Загрузка...
