Пресс-центр / новости / Наука /
К вопросу о селективности калиевых каналов, или откуда белкáм известно о квадратной антипризме?
Калиевые каналы — одни из главных игроков в проведении нервного импульса, а мутации их генов приводят к неврологическим и сердечно-сосудистым заболеваниям. Важнейшая особенность K+-каналов — высочайшая селективность в отношении K+ по сравнению с Na+ и другими катионами. В новой работе сотрудники Группы анализа структуры мембранных белков in silico и Лаборатории молекулярных инструментов для нейробиологии проанализировали все известные 3D-структуры мембранных белков. В результате подтвержден ключевой принцип строения селективного фильтра K+-каналов: в нем атомы кислорода основной цепи белка выстраиваются в цепочку квадратных антипризм, в точности соответствуя сольватной геометрии иона калия. Искажение фильтра, например при инактивации, отслеживается разработанным авторами алгоритмом, что может использоваться для структурной классификации.
Пространственное строение первого изученного K+-канала — бактериального белка KcsA — было установлено исследователями под руководством Родерика МакКиннона в 1998 году, за что он позже получил Нобелевскую премию. Они же определили, что селективный фильтр (СФ) — консервативная конструкция в поре канала, отвечающая за избирательное пропускание только ионов калия, — замечательно точно воспроизводит строение гидратированного иона K+: каждый из четырех сайтов СФ, способных связывать калий (S1–S4), образован восьмерками атомов кислорода в геометрии квадратной антипризмы, что обеспечивает проведение иона в десольватированной форме без энергетического штрафа. С тех пор структурная биология шагнула далеко вперед, и сегодня доступно уже >350 структур различных K+-каналов. Мы задались вопросами: “А во всех ли калиевых каналах механизм селективности тот же?” и “Уникален ли селективный фильтр для K+-каналов, или же его можно найти и в других белках?”
Различные катионы металлов гидратированы (“одеты” молекулами воды) по-разному: их отличает координационное число, геометрия сольватации и характерное расстояние от иона металла до окружающих молекул H2O. Ион K+ “одет” восемью молекулами воды, организованными в квадратную антипризму — тело, напоминающее скрученный куб (рис. 1Б). Именно антипризма стала шаблоном, по которому созданный нами алгоритм ищет сайты связывания K+ в структурах белков (рис. 1А).
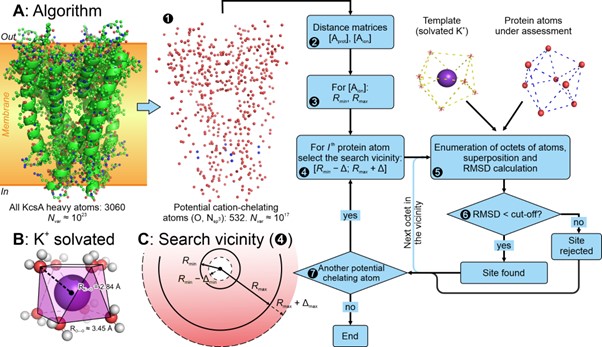
Рисунок 1. Алгоритм поиска K+-связывающих сайтов в структурах белков. Потенциально хелатирующие ион атомы белка делятся на локальные восьмерки атомов (схема алгоритма на панели A), которые сравниваются с шаблоном (панель B). В случае хорошего соответствия (среднеквадратичное отклонение < 1.25 Å) восьмерка объявляется сайтом связывания K+ и сохраняется для дальнейшего анализа.
Алгоритм безошибочно находит сайты S1–S4 в структурах СФ K+-каналов, аннотированных как активные (рис. 2). По-видимому, именно четыре соосных сайта обеспечивают высокую селективность к калию; во всех прочих белках таких структур не найдено. Нечто похожее на классический СФ обнаружено в родственных K+-транспортирующих белках, но там в силу особенностей строения находится не более двух сайтов, что приводит к снижению селективности.
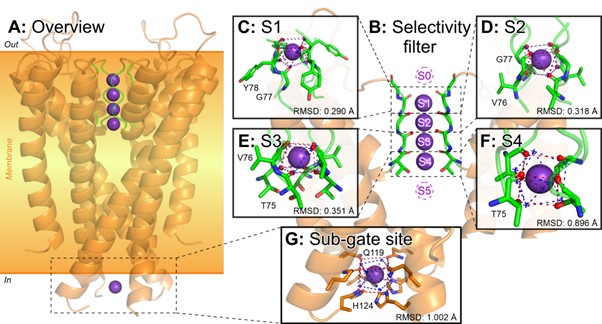
Рисунок 2. K+-Связывающие сайты в калиевых каналах четко указывают положение селективного фильтра. Алгоритм безошибочно находит соосные четверки таких сайтов в структурах активных калиевых каналов, что является основой избирательного пропускания ионов. Интересно, что в некоторых K+-каналах (и прочих белках) находятся сайты связывания и за пределами СФ (панель G), однако они никогда не выстраиваются в подобие СФ.
Интересно, что не во всех структурах K+-каналов алгоритм находит ровно четыре сайта в СФ (рис. 3). В некоторых случаях их не находилось совсем, или же регистрировались один–два сайта. Оказалось, что такие структуры соответствуют инактивированным состояниям канала, СФ которых искажен и не может проводить ионы, либо мутантным формам с потерей селективности к K+. Наш алгоритм надежно регистрирует такие случаи.
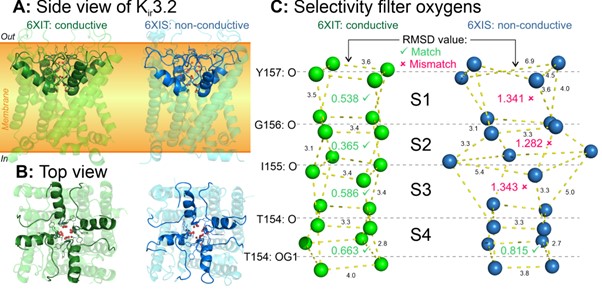
Рисунок 3. Искажение селективного фильтра K+-каналов — механизм инактивации C-типа. Первый взгляд на “нормальную” и инактивированную структуры вряд ли позволит отличить их (панели A, B). Однако наш алгоритм выявляет ключевое отличие: в структурах, зафиксированных в инактивированном состоянии, СФ существенно искажен, что разрушает находящиеся в нем K+-связывающие сайты (панель C).
Помимо всех доступных структур K+-каналов, в работе проанализированы все известные структуры прочих мембранных белков (>7000) и выборочно — немембранные белки (≈10 000). Мы показываем, что число K+-связывающих сайтов в них драматически меньше, и нигде они не выстраиваются в структуры наподобие СФ. Однако такие сайты идентифицированы в K+-транспортирующих белках (каналы NaK, CNG, HCN и Na+/K+-АТФазы), обеспечивая им функционал связывания ионов.
Отвечая на вопрос, поставленный в заголовке этого релиза, можно с уверенностью сказать, что квадратная антипризма хелатирующих атомов в белках — ключевой мотив координации ионов калия.
Работа опубликована в журнале International Journal of Biological Macromolecules и бесплатно доступна до 10 апреля 2025 г.
february 24


