12-ти членный пептид Tag7 формирует цитотоксичный комплекс с Hsp70 и ингибирует TNFα индуцированную клеточную гибель
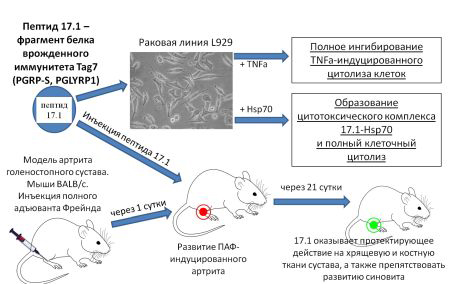
Ранее команда ученых из Ветеринарной службы и Лаборатории биоинженерии нейромодуляторов и нейрорецепторов продемонстрировала, что белок врожденного иммунитета Tag7 (PGRP-S, PGLYRP1) может взаимодействовать с рецептором TNFα, TNFR1, и блокировать передачу апоптических сигналов через этот рецептор. Комплекс, образованный между белком Tag7 и основным белком теплового шока Hsp70, может активировать рецептор TNFR1 и вызывать гибель опухолевых клеток через апоптотический или некроптотический путь. В этом исследовании было показано, что 12-членный пептид 17.1, который был получен из белка Tag7, может рассматриваться как новый ингибитор TNFα, способный образовывать цитотоксический комплекс с белком теплового шока Hsp70. Кроме того, этот новый ингибиторный пептид 17.1 демонстрирует противовоспалительную активность на модели аутоиммунного артрита, индуцированного полным адъювантом Фрейнда (ПАФ), у лабораторных мышей линии BALB/c. По-видимому, пептид 17.1 потенциально может быть использован в качестве противовоспалительного средства. Работа была опубликована в Cells.
march 3, 2020

